Участники третьей волны акселерационной программы ТГУ познакомились с основными трендами разработки противоопухолевых препаратов. В своем экспертном выступлении «Что мы знаем о механизмах метастазирования опухолей и как нам его предотвращать» Николай Литвяков, доктор биологических наук, профессор РАН, заведующий лабораторией онковирусологии НИИ онкологии Томского НИМЦ, поделился со слушателями своим мнением по этому волнующему многих вопросу.
Томский НИМЦ выступает индустриальным партнером акселерационной программы ТГУ. В своем выступлении Николай Литвяков дал советы студентам о том, на что обратить внимание при сохранении своего здоровья, и подчеркнул: медицинская помощь пациентам должна быть персонализированной. Это касается не только борьбы с онкологией, такой подход пригодится и будущим стартапам для рынка «Хелснет». Ранее в своем экспертном выступлении на акселераторе руководитель Инфраструктурного центра Хелснет (Новосибирск) Мария Галямова рассказала участникам, что центр собирает наработки по персонализированной медицине и готов оказывать помощь таким проектам.
Переходя к основной теме своего выступления, Николай Литвяков сообщил: возможность остановить распространение злокачественных опухолей в организме есть. Сейчас ученые работают над совершенствованием методов этой борьбы.
Так, Томский НИМЦ, СибГМУ, Томский государственный университет, Башкирский государственный медицинский университет и несколько учреждений Москвы в рамках совместного проекта разработали препарат с рабочим названием «Бактоферон». Это живые бактерии Bacilius S., в геном которых встроен ген человеческого альфа2-интерферона. Попадая в кишечник, эти бактерии начинают продуцировать там человеческий интерферон, а он уже индуцирует выработку в организме эндогенного гамма-интерферона. Тот, в свою очередь, приводит к «засыпанию» опухолевых клеток и препятствует их «пробуждению».
Называть опухоли термином «рак» некорректно – «рак» в русской транскрипции это опухоли эпителиального происхождения, а есть еще много других видов опухолей, подчеркивает Николай Литвяков.
Отвечая на вопрос, что же собой представляет онкологическое заболевание, он сравнивает его с ОПГ – организованной преступной группировкой. Если посмотреть на то, как распространяются метастазы, мы увидим, что первичная опухоль дает метастазы в другие органы и распространяется по всему организму – так же, как распространяются ОПГ в той или иной стране. Кроме того, в структуре опухоли, как и в ОПГ, есть своя иерархия – у разных членов своя роль и степень «авторитета». Самый главный член в иерархии опухоли – опухолевая стволовая клетка («авторитет»), от нее происходят все остальные клетки опухоли. Так что онкологи – практически полицейские для организма, в котором поселилась опухоль.
Развитие метастатической болезни даже после, казалось бы, радикально проведенного комбинированного лечения, является основной причиной смерти онкобольных в различные сроки после удаления первичной опухоли. В зависимости от локализации опухоли и стадии заболевания, процент больных, у которых развиваются метастазы, колеблется от 15 до 90%. Наибольший показатель здесь относится к больным с раком поджелудочной железы, а наиболее благоприятный прогноз – у пациентов с раком щитовидной железы. Развитие метастазов зависит, конечно, от лечения, стадии и локализации опухоли и других причин.
Как происходит метастазирование?
Злокачественной опухоль признается в том случае, если ее клетки способны к инвазии – то есть, могут двигаться, прорывая подложку, на которой лежат. Это движение продолжается до достижения сосуда – кровеносного или лимфатического. Проникая в него, опухолевая клетка становится циркулирующей и, если циркуляция идет по кровеносному сосуду, может достигать любого органа. В определенном месте – чаще всего это происходит в печени, легких, головном мозге и костях – опухолевые клетки выходят из кровеносного русла и поселяются в органе, которого достигли. Образовав там микрометастаз, опухолевые клетки, чтобы стать невидимыми для иммунной системы, «засыпают» на определенный период и никак не проявляют себя – как правило, на время лечения, которое проходит пациент, а вообще это может длиться десятки лет. Переждав этот период, клетки дают начало макрометастазам, которые будут расти. Именно от них, в конечном счете, больной и погибает.
– Проблема в том, что как только опухоль становится злокачественной, она сразу начинает давать семена. И на момент постановки диагноза она уже прошла весь путь от инвазии до образования микрометастазов. То есть, если человеку при постановке диагноза говорят, что метастазов нет, это не значит, что нет микрометастазов. Они есть всегда, как только поставили диагноз «злокачественная опухоль». Дальше – вопрос только времени и генетической потенции этих опухолевых клеток: перейдут ли они из состояния микрометастазов в состояние макрометастазов. Это может занимать от 3 месяцев до 20 лет, – рассказывает Николай Литвяков.
Правда, риск метастазирования снижается после пяти лет начиная с постановки диагноза и далее идет по убывающей.
В мировой медицинской практике до сих пор встречаются бесполезные стратегии предотвращения метастазирования. Но клинические исследования показывают – препараты, которые направлены на предотвращение инвазии, прикрепления к сосуду, проникновению в него, циркуляции, экстравазации, формирования метастатических ниш и образование микрометастазов, бесполезны для предотвращения метастазирования.
Так, к примеру, ученые предпринимают попытки научиться уничтожать опухолевые клетки еще на этапе выхода из кровеносного или лимфатического сосуда. В этот момент они наиболее уязвимы, но клетка-«авторитет» в первичной опухоли дистантно перепрограммирует локальную иммунную систему, и некоторые опухолевые клетки проходят этот этап. Противостояние ученых этому процессу сейчас находится максимум на стадии первой фазы клинических испытаний, и насколько успешным будет этот опыт, неизвестно.
Одним из этапов комбинированного лечения опухолей в современных рекомендациях является предоперационная системная терапия. Это может быть химио–, таргетная, гормональная или иммунотерапия. Такая терапия может убивать опухолевые клетки на этапе их перехода к «спящему» состоянию или даже «спящие». Если так совпало, что предоперационная терапия полностью уничтожила первичную опухоль, есть вероятность почти в 90 %, что она убьет и «спящие» микрометастазы – и больные, которым повезло, после этого живут 10 и более лет. Но в противном случае такая терапия может нанести и вред, стимулировав эволюцию первичной опухоли. Поэтому изначально медики должны установить, способна ли она давать метастазы. Если оказывается, что нет, не стоит воздействовать на нее терапией до удаления первичной опухоли.
Единственный этап, на котором можно действительно предотвратить метастазирование, – это этап образования макрометастазов. Соответственно, все лечение должно быть направлено на то, чтобы предотвратить это превращение.
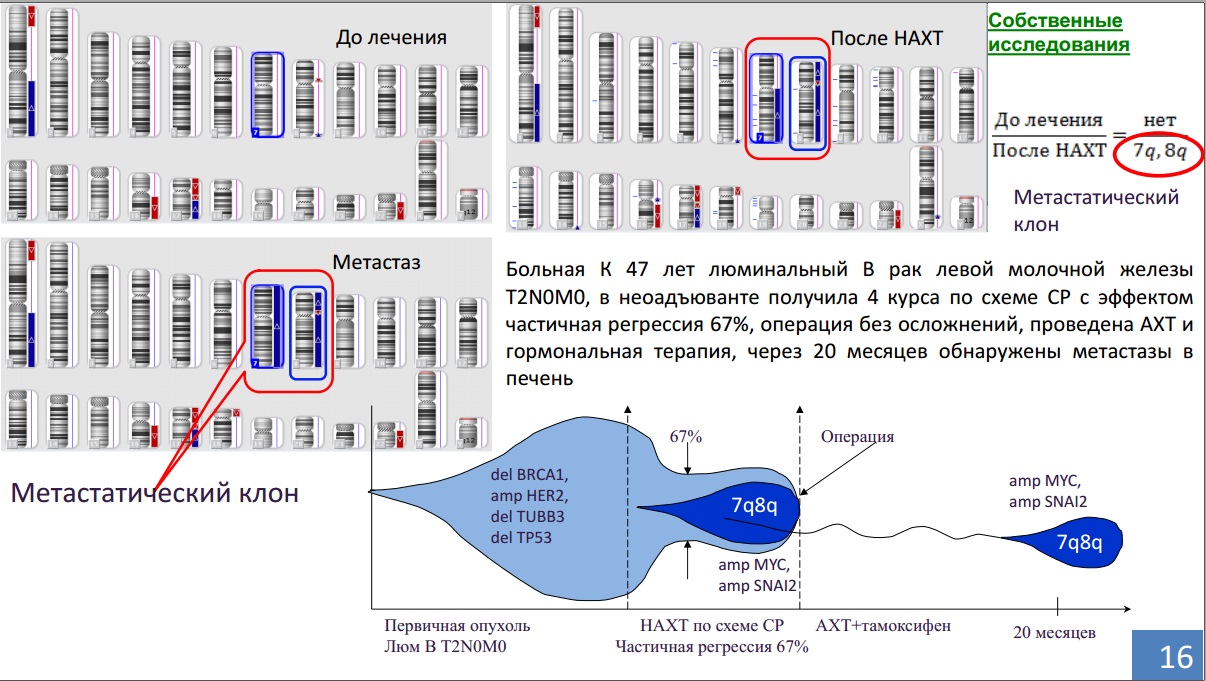
Исследования показывают, что за 20 лет, даже с учетом огромных успехов в лекарственной терапии, эффективность получения полной морфологической регрессии опухолей молочной железы – а это те самые случаи, которые дают выживаемость на уровне 90% – выросла всего на 9%.
– Такова безжалостная логика, если всех без разбора всем подряд лечить одинаково. Еще Гиппократ говорил, что надо лечить больного, а не болезнь. К сожалению, у фармакологических компаний все наоборот – надо лечить болезнь безотносительно больного. А каждому больному нужно свое лекарство в свое время, чтобы подход был персонализированный, – замечает Николай Литвяков.
Что же нужно делать, чтобы предотвратить метастазирование?
Мы помним, что микрометастазы в органе уже есть. Остается только две точки, на которых возможна дальнейшая борьба. Это точка выхода из «спящего» состояния и точка, в которой дифференцированная опухолевая клетка превращается в стволовую опухолевую клетку.
Если говорить о современных тенденциях, то сейчас все лечение, которое имеется в арсенале онкологии, как раз направлено на этот этап. Речь идет о послеоперационной терапии, когда первичной опухоли уже нет. Воздействуя системно на все органы и ткани, эта терапия по большому счету делает одну вещь – препятствует выходу опухолевых клеток из «спящего» состояния, повреждая их и, возможно, частично убивая. Но есть и проблемы.
Первая – гетерогенность опухоли. Она состоит из клеток, разных по функциям и свойствам. Так же и микрометастазы – гетерогенны. Одни из них чувствительны к препарату, другие нет; одни могут погибнуть, другие повреждаются лишь на время. При этом микрометастазы настолько малы, что современная медицина ничего не знает о том, как на них действует терапия. Вторая проблема – возникающая устойчивость к долго используемым препаратам. Третья – любая терапия мало связана с механизмом выхода опухолевой клетки из «спящего» состояния. Она направлена на уничтожение таких клеток или их стабилизацию, но не предотвращает «пробуждение». Наконец, послеоперационная терапия ограничена по времени – рано или поздно из-за токсичности препаратов лечение прекращается, и барьер на пути к выходу опухолевых клеток из «спящего» состояния снимается.
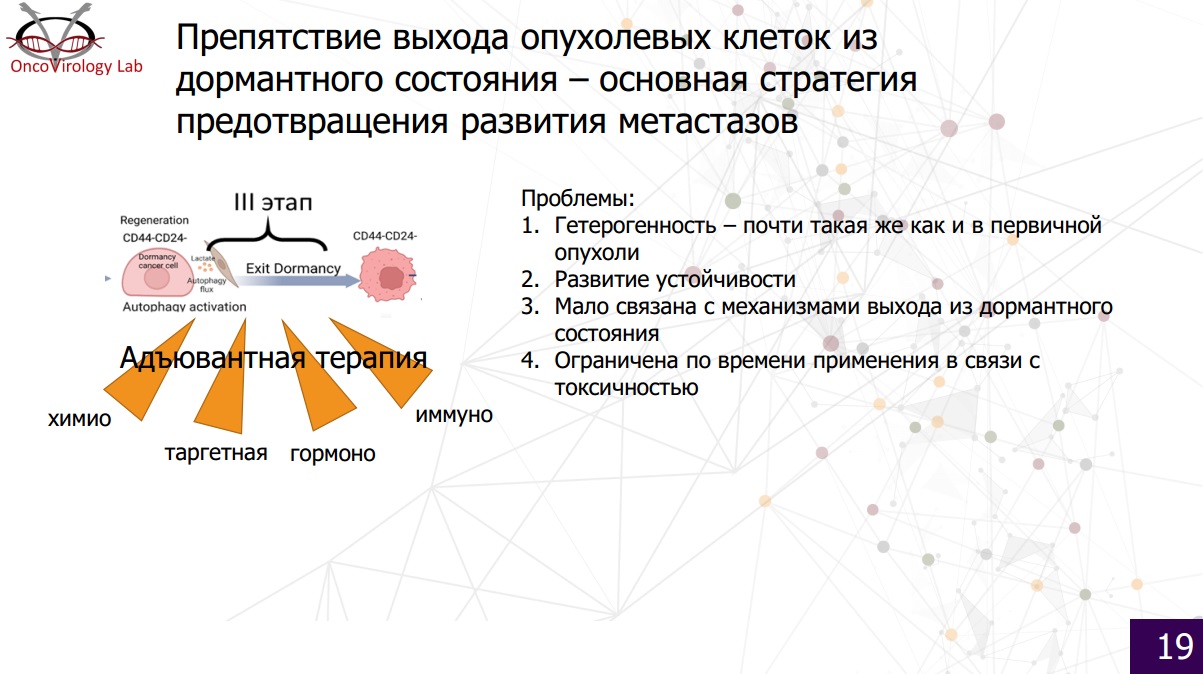
Как предотвращать появление макрометастазов?
Сыграть свою роль в перепрограммировании системного иммунитета организма в противоопухолевом направлении может микроокружение метастазов – при условии, что в организме уже не будет подпитывающего опухолевого центра.
Говоря о новом препарате «Бактоферон», Николай Литвяков замечает: конечно, после всех этапов вывода на фармакологический рынок он не будет использоваться в монотерапии, а вот в комплексной, как надеются разработчики, будет очень хорош.
– Он абсолютно безвреден – бактерии легко выводятся из организма в течение двух суток. Система запуска эндогенного гамма-интерферона срабатывает через неделю – к этому времени он выходит на хороший системный уровень и держится около месяца. Потом курс надо будет повторить и так далее... Пациентам, которые сейчас проходят послеоперационную терапию, применение этого препарата, как нам кажется, даст возможность перепрограммировать иммунитет в противоопухолевом направлении и будет препятствовать выходу опухолевых клеток из спящего состояния, – рассказал Николай Литвяков.
Добавим, что полностью это экспертное выступление, как и все другие, участники акселератора ТГУ могут посмотреть в записи.
Для справки: Акселерационная программа ТГУ реализуется в рамках федерального проекта «Платформа университетского технологического предпринимательства». Он направлен на развитие технологического предпринимательства в России и ориентирован на студентов, вузовское сообщество и инвесторов. В настоящее время идет третья волна акселератора ТГУ, он продлится до 15 декабря и завершится демоднем.